パターンイルミネーター導入事例
Mightex systemsが提供するパターンイルミネーション技術はオプトジェネティクス光刺激に置いて選択的、部分的に光を照射することが可能となります。代表的なアプリケーションとして細胞分解能オプトジェネティクス:”ニューロン集団内の個々のニューロンに限定して光刺激すること”が挙げられます。Polygon DMDイルミネーターを使用することにより、より正確に、複雑なオプトジェネティクス実験を実行可能です。
本記事ではオプトジェネティクス実験でのDMDイルミネーターの導入事例について解説します。
目次
チャネルロドオプシン-支援回路マッピング(CRACM)- Kissinger et al.2020 Cell Reports
Kissingerら研究者は2020年に脆弱X症候群のマウスモデル(Fmr1 ノックアウトマウス)における知覚障害を検証した論文をCell Reports誌に発表した。彼らの研究室は以前、視覚的誘発性の低周波振動が既知の刺激を符号化する際にV1で発生することを示しており、2020年の論文ではFmr1ノックアウトマウスにおける近く中の低周波振動とそれに伴う回路変化に潜在的な異常がないか調査した。
著者らは、局所場電位と単一ユニット記録を使用して、既知の見慣れた視覚刺激の提示後に、Fmr1 マウスは視覚皮質の複数の層における振動の持続時間が短く、パワーが低く、周波数が低いことを実証した。
これに続きMightex社のPolygon DMD イルミネーターを用いてチャネルロドプシン支援回路マッピング(CRACM)を実施し、V1における潜在的な接続変化を調査した。このPolygon DMDイルミネーターを用いることで光刺激を用いて単一細胞間での接続を解析することが可能となった。
チャネルロドプシンは、Thy1-ChR2-YFPマウスとの交配により、対照動物とFmr1ノックアウト動物で発現させ、パッチクランプ電気生理学を用いて細胞間の接続を試験し、具体的には、層5-層4および層5-層5の細胞間の接続を確認した。細胞をパッチングしている間、個々の細胞は、Polygon DMDイルミネーター(L2からL3までの正方形を覆う)を使用して、10×10グリッド(0.67 mm×0.67 mm)内で刺激した。個々のニューロンを刺激するために、10 倍の対物レンズを通して 10 ms のパルス刺激が可能な 470 nm LED 光源が使用された(対物レンズ下で 0.3 mW)。
Kissingerらは、対照動物では第5層から第4層の細胞に高速発火の有意な増強が見られるのに対し、Fmr1ノックアウト動物では知覚経験後に変化が見られないことを示した。さらに、Fmr1ノックアウト動物では知覚経験後に第5層から第5層のニューロンに抑制が見られた。
この研究は、脆弱X症候群の動物モデルが情報をエンコードする方法における重要な違いを示し、MightexのPolygonをCRACMに用いて、Fmr1ノックアウトマウスにおける回路変化を明らかにした。
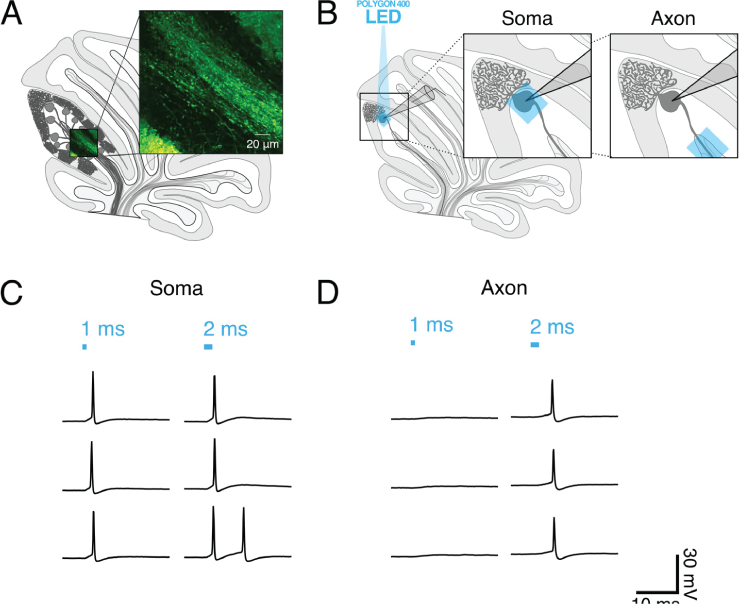
小脳における局所光刺激-Gruver&Watt 2019 Frontiers in Synaptic Neuroscience
GruverとWattは2019年、Frontiers in Synaptic Neuroscience誌に、Mightex社のPolygon DMD イルミネーターを用いて小脳のプルキンエ細胞と軸索を局所的に光刺激するためのパラメータを解明する論文を発表した。
小脳切片にChR2を発現させ、パッチクランプ電気生理学を用いて神経活動を測定した。細胞体をパッチングすると同時に、その細胞の細胞体または白質(軸索)を、Mightex社製Polygon DMDイルミネーターを用いて40μm×40μmの範囲を個別に照射した。光刺激は、約100mW/mm2の強度で60倍対物レンズを用いて実施された。
GruverとWatt(2019)は、単一の活動電位を誘発するのに最適な光刺激を決定するために、様々なパルスパラメータをテストし、単一の活動電位を誘発するには、軸索(2~3ms)では細胞体(1ms)よりも長いパルス光刺激が必要だということを示した。
また、小脳におけるプルキンエ細胞とシナプス後DCNニューロン間の接続を、局所的な光刺激を用いて試験し、DCN細胞の細胞体をパッチし、シナプス前プルキンエ細胞の軸索を局所的に光刺激した(DCN細胞から200μm離れた位置)。この研究により、光刺激のパルス幅が増加すると、DCN細胞におけるシナプス後応答が増加することが明らかとなった。
本研究では、MightexのPolygon DMD照明装置を用いて単一活動電位を誘発し、小脳の神経回路を試験する、効果的な局所刺激プロトコルを実証したと言える。
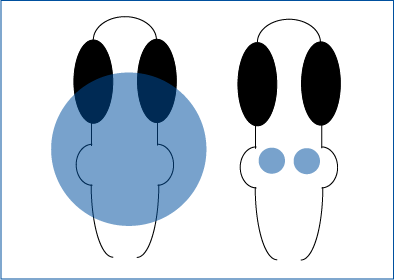
ゼブラフィッシュにおけるターゲット照明 - Tabor et al. 2018 Current Biology
Taborら(2018)は、プレパルス抑制(PPI)を用いてゼブラフィッシュの感覚フィルタリングの細胞基盤を解析した。PPIは、動物を軽度の刺激に事前に曝露し、その後に警告刺激を提示することで行われる。PPIに対する自然な反応は、事前曝露によって警告刺激への反応が減少することである。
初期の実験では、カルシウムイメージングを用いて、ゼブラフィッシュ脳のR4ドメインがPPI反応と相関していることを明らかにした。著者らは、オプトジェネティクス光刺激を用いてゼブラフィッシュのR4ドメインを選択的に活性化することで、このPPI反応をシミュレートできるかどうかを検証することになった。
Mightex社のPolygon DMD イルミネーターを用いて、ChR2を発現するゼブラフィッシュ脳内の個々の領域を光刺激し、PPI反応を測定した。460 nm LEDを搭載したPolygonを用いて、後脳全体に341 µm幅の正方形を照射するか、あるいは33~50 µm幅の正方形を用いてより小さな領域を照射し、R4ニューロンを選択的に活性化した。
後脳またはR4ニューロンのいずれかを光刺激すると、光刺激から400 ms後にパルスが与えられた際に驚愕反応が抑制された。この反応は、ニューロンがパルスのみの照射または刺激前に発火した場合には抑制されなかった。本論文では、Taborら(2018)は、ゼブラフィッシュのPPIに対する脳幹運動回路を実証し、センサリーゲーティングを試験した。
パッチクランプ電気生理学による標的照明-Andrasi et al. 2017 PLOS Biology
Andrasiら(2017)は、扁桃体基底核における錐体ニューロンと介在ニューロン間の接続性、そしてこれらの相互作用が活動をどのように制御するかを調査した。彼らは、オプトジェネティクス、パッチクランプ電気生理学、顕微鏡技術など、様々な手法を用いてこれらの疑問にアプローチした。
ある実験では、コレシストキニン(CCK)およびパルブアルブミン(PV)介在ニューロンが扁桃体の錐体ニューロンから直接入力を受けるかどうかを検証し、Andrasiらは、ChR2を発現する周囲の錐体ニューロンを光刺激し、同時にCCKまたはPV介在ニューロンの活動を電気生理学的に記録することで、この検証を行った。Mightex社のPolygon DMDイルミネーターを用いることで、Andrasiらは介在ニューロン周辺のランダムに選択した錐体細胞に、15~20μmのスポットを用いて50msの間、青色光を照射することに成功し、オプトジェネティクス光刺激のシナプス後応答は、CCKまたはPV細胞で測定された。
著者らは、細胞分解能のオプトジェネティクス光刺激を用いて、錐体細胞がCCK細胞よりもPV介在ニューロンと接続される可能性が高いことを実証した。さらに、記録細胞のXY座標と光遺伝学的刺激を受けた錐体細胞体からの距離を用いて、接続マップを作成した。その結果、PV細胞は遠距離ではなくより近い錐体細胞と接続され、CCK接続は距離に依存しないことが示された。結論として、本論文は扁桃体におけるPV介在ニューロンとCCK介在ニューロンの細胞ネットワークが異なる機能を持つことを示した。
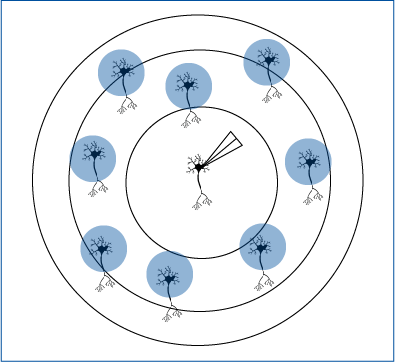
拡散を検出するためのMEAによる選択的光遺伝学的刺激-Papasavvas et al. 2020 eNeuro
介在ニューロンはギャップジャンクションによって他の介在ニューロンと直接結合しており、これにより非常に特異的な興奮性結合が実現している。ギャップジャンクションを介した伝播が活動の増加とどのように関連しているかは、よく分かっていない。Papasavvasら(2020年)は、細胞外カリウム濃度の上昇が極度のニューロン活動と関連する可能性があるという仮説を検証した。
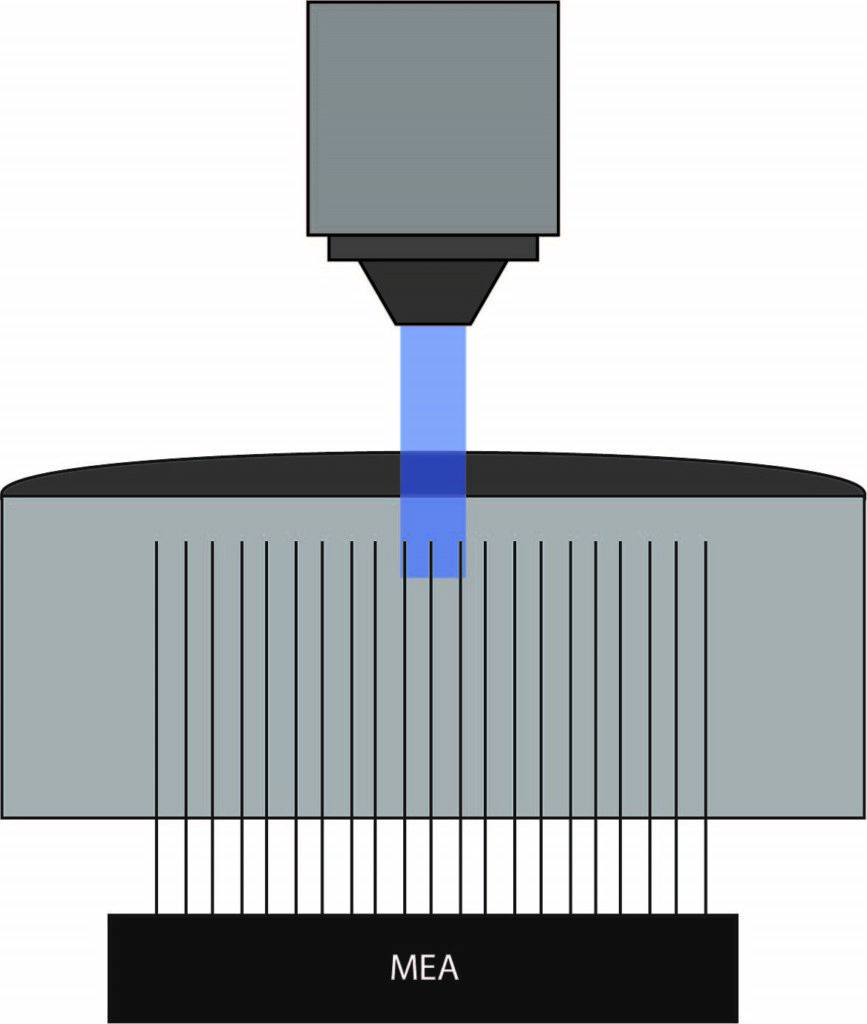
この仮説を検証するため、著者らは正常またはカリウム濃度が上昇したスライス標本において電気生理学的活動を記録し、オプトジェネティクスを用いてChR2を用いてパルブアルブミン発現介在ニューロンを活性化した。フィールド電位は、後頭葉皮質スライスのV層に沿って配置したMEAを用いて測定した。Mightex社のPolygon DMDイルミネーターを使用し、3~4個の隣接する電極(300~400μm×10μm四方)を470nmのLEDで照射した。実験は4倍対物レンズを用いて実施し、約2mWの照射光量で実施された。
Papasavvasら(2020)は、細胞外カリウム濃度のベースラインでは、神経活動は照射された電極に限定されることを示した。しかし、カリウム濃度を上昇させると、オプトジェネティクス光刺激後に自発活動が増加し、記録部位から少なくとも150μm離れた場所で時間同期したバースト発火が観察された。照射部位からの伝播を示すスライスの割合は、関連する細胞外カリウム濃度の増加に伴い増加した。本論文では、Papasavvasらはパターン照明とMEA記録を用いて、細胞外カリウム濃度が介在ニューロンの自発活動に影響を与えることを実証している。
電気生理学を用いた細胞体標的光遺伝学-Anastasiades et al. 2020 Biorxiv
前頭前皮質(PFC)、内側背側(MD)、および腹内側(VM)の視床核の間には相互接続が存在する。しかし、これらの異なる視床核が前頭前皮質とどのように通信するかは不明だった。Anastasiadesら(2020)は、解剖学的トレーシング、電気生理学、オプトジェネティクスなどの手法を用いて、これらの接続の性質を解明しようと試みました。
著者らはまず、解剖学的トレーシングを用いて、VM投射がPFCの1a層に、MD投射がPFCの1b層に存在することを実証した。具体的には、NDNF細胞はPFCの1a層でVMからの入力を受け取り、VIP細胞はMDの1b層でMDからの入力を受け取ることが明らかになった。これらの知見は、PFC-視床回路が別々に存在することを示唆している。
これらの直接的な接続が確立されたことを受けて、Anastasiadesら(2020)は、視床から直接入力を受けるこれらの異なる細胞種が、局所的なPFC回路内でどのように通信するかを調査した。彼らは、ChR2を発現するNDNF細胞とVIP細胞をオプトジェネティクス光刺激した後、局所的なパルブアルブミン介在ニューロン、ソマトスタチン介在ニューロン、および錐体ニューロンからの応答を記録した。興味深いことに、VIP誘発性IPSCSはソマトスタチン介在ニューロンでのみ発生し、錐体細胞やパルブアルブミン介在ニューロンでは発生しなかった。逆に、NDNF誘発性IPSCSはパルブアルブミン介在ニューロンと錐体細胞で発生したが、ソマトスタチン介在ニューロンでは発生しなかった。これらの知見は、著者らの以前の実験を拡張し、PFC内に異なる微小回路が存在することを実証した。
著者らは、NDNF+細胞と錐体細胞との結合が前頭前皮質第1層に限定されないことを示した。細胞体標的オプトジェネティクスを用いて、錐体細胞に結合したNDNF+細胞の位置を特定した。NDNF+細胞はオプトジェネティクス構築物st-Chromeを発現し、これは青色光によって活性化された。Mightex社の473nm LEDを搭載したPolygon DMDイルミネーターを用いて、10倍対物レンズ下で10×10の擬似ランダムグリッド(マッピング領域750μm×750μm)を照射した。その後、電気生理学的手法を用いて錐体細胞における反応を測定した。
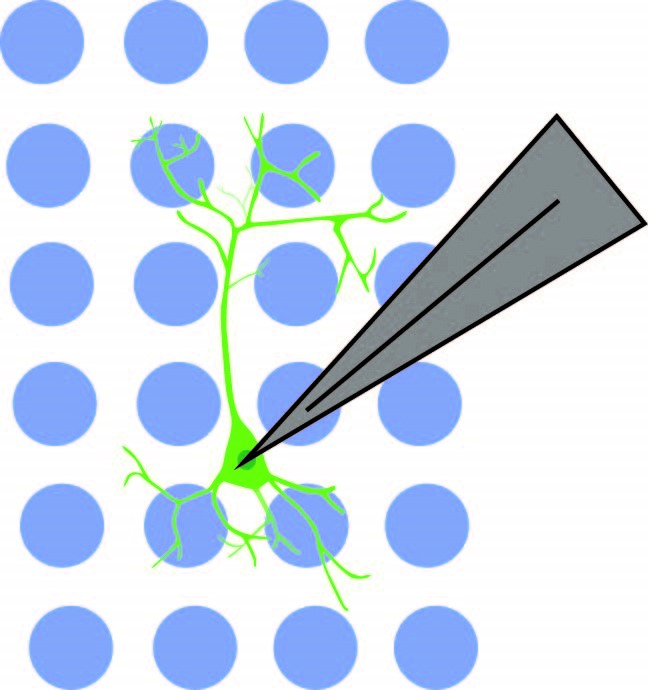
著者らはst-Chrome細胞体標的オプトジェネティクス活性化のパラメータを確立した。活性化は細胞体に直接光を照射した場合にのみ検出され、照射スポットが細胞体から75μm離れた場合には反応が検出されなかった。著者らは細胞体標的オプトジェネティクスを用いて、錐体細胞が主に第1層のNDNF+からの入力を受けるが、第2層、第3層、および第5層からもいくらかの入力を受けることを示した。本論文では、Anastasiadesら(2020)が複雑な長距離PFC-視床回路を示している。