オプトジェネティクス 光刺激ガイド
オプトジェネティック(光遺伝学的)光刺激は光を照射することにより脳の特定のニューロン集団の活動を活性化または抑制できるようにする遺伝学的手法です。本ガイドではオプトジェネティクスに関する重要な項目について解説します。
目次
Chapter1:オプトジェネティクスとは?
神経科学者は長年、神経回路の活動から動物の行動や認知がどのように生じるのか理解することに挑んできました。
調査を実施するにあたり、以前は薬理学的かつ不正確な電気刺激を用いてきました。しかし脳内では様々な種類のニューロンが広大で複雑なネットワークと高速の電気信号を介して通信するため、神経回路の活動を解読するにはニューロンを正確に制御できる方法の開発が不可欠でした。
1979年、フランシス・クリックは光を使用してニューロンを制御するという新しい解決例を提案しました(Boyden et al. 2005)。このアイデアから派生し、多くの研究者の改良によりオプトジェネティクスという革新的な技術が生まれました。
光照射によって特定のニューロンのオン/オフを切り替える手法は2005年にカール・ダイセロスとエドワード・ボイデンによって発明され、ピーターヘーゲマンという研究者の発見から開発が始まりました。ヘーゲマンは青色光脱分極オプシンであるチャネルロドプシン-2(ChR2)を細胞培養で発現させることに成功しています(Nagel et al. 2003)。
これらの発見を発展させて、ダイセロスとボイデンはニューロンでChR2をウイルス発現させ、ニューロンが青色光を使用して活性化できることを初めて実証しました。
オプトジェネティクスはミリ秒単位の精度でニューロンのスパイクを高速に制御できます。光学と遺伝学の両方を使用する技術としてオプトジェネティクスという用語が誕生しました。
オプトジェネティクスはどのように機能するのか?
オプトジェネティクスはChR2というオプシンの発見から始まりました。オプシンは光に敏感なチャンネルでイオンの流入やたんぱく質シグナル伝達カスケードなどのメカニズムを通じてニューロンの脱分極または過分極を引き起こします (Kim et al. 2017)。
オプシンは特定の波長の光に敏感で神経活動の活性化または抑制につながります。例えば、青色光(470nm)はChR2を活性化し、Na+イオンの流入を引き起こし、ニューロンを脱分極させます (Boyden et al. 2005)。ウイルス遺伝子発現とトランジェニック動物モデルにより、研究者はプローブを遺伝的に定義されたニューロン集団と脳全体に投影することが可能となります(Kim et al. 2017)。
神経科学者、生物学者、エンジニアなどの多分野におけるコラボレーションにより、オプトジェネティクスで使用されるツールは開発されてきました。オプシンは様々な速度と波長でニューロンのオン/オフを制御するために発見されてきました。例を挙げると、抑制性オプシンであるハロルドプシンはニューロンをオフにすることがわかり、JAWSなどの赤色活性化オプシンは脳のより深くまで浸透するように開発されました (Kim et al. 2017)。
| オプトジェネティック構造 | 励起波長 | 機能 |
|---|---|---|
| ChR2 | 470nm | 活性化 |
| GtACR2 | 470nm | 制止 |
| ArchT | 540nm | 制止 |
| C1v1 | 560nm | 活性化 |
| NpHr | 590nm | 制止 |
| bReaChES | 590nm | 活性化 |
| Chrimson | 590nm | 活性化 |
| ReaChR | 620nm | 活性化 |
| JAWS | 620nm | 制止 |
オプトジェネティクスの応用
オプトジェネティクスは様々な種類の細胞の活動をミリ秒単位の精度で制御する機能を提供することにより、多くの科学分野に恩恵をもたらしています。
神経科学分野では、オプトジェネティクス技術によって神経回路、行動、機能の関連付けが可能となりました。光遺伝学は試験管内で実施されるin vitroと動物の生体内で実施されるin vivoで行われます。げっ歯類、霊長類、C.elegans、ショウジョウバエ、ゼブラフィッシュなどが認知と行動の神経送還を研究するために多く利用されています。
細胞活動を正確に制御する方法として、オプトジェネティクスは神経科学以外の科学分野にも影響を与えており、近年では細胞生物学や心臓研究にも貢献しています (Repina et al. 2017; Ferenczi et al. 2019)。
臨床的観点からは、光遺伝学の応用は運動疾患における視力回復や脳深部刺激の研究に使用され始めています (Towne & Thompson 2016)。
光遺伝学は、ニューロン活動の機能をリアルタイムで分析する因果的手法により、脳に対する理解を深め、将来的には臨床的に重要な意味を持つようになるかもしれません。
Chapter2:オプトジェネティクスを実施するために必要な機器
オプトジェネティクスは、特定のニューロン群を活性化または抑制する能力をコントロールします。オプトジェネティクスへの注目は、2005 年の発明以来、この技術を特集した出版物の急増からも明らかです (Boyden 他 2005)。比較的新しい技術であるため、目的の研究を実施するためにどのような機器が必要かしっかりと理解する必要があります(Boyden et al. 2005)。
生物学的コンポーネント
オプトジェネティクスを成功させるための最初のステップは、生物学的構成要素を把握することです。これには、適切なプローブ(ChR2, GtACR2など)の選択、目的の脳領域とニューロンで発現させること、および適切な光カニューレの埋め込み (自由行動実験を実行する場合) が含まれます。
発現
適切な光遺伝学プローブの選択が最初のステップとなります。
それに伴って対象のニューロン群を活性化するのか、または阻害するのか。どのくらいの速さで刺激する必要があるのか。光刺激のために特定の光波長が必要となるのか、といったことを検討する必要があります。
これらは、実験に適したオプトジェネティック プローブを選択するのに役立つ質問の一部です (現在利用可能なオプトジェネティック プローブをまとめた Addgene の優れたガイドhttps://www.addgene.org/guides/optogenetics/)。
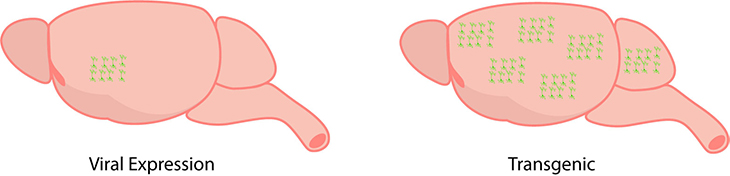
プローブを選択したら、それを脳内で発現させる必要があります。脳内でプローブ構造を発現させるためには、ウイルス発現とトランスジェニマックマウスモデルの2つの方法が挙げられます。
ウイルス発現には、オプシンをコードしたウイルスを脳に注入します (Mei & Zhang 2012)。このウイルスは特定の細胞タイプへの発現をターゲットとする遺伝子とリンクされています (Mei & Zhang 2012)。
この方法を利用してオプシン発現を調節したり、特定の脳領域に制限したりすることが可能となります。このコントロール性は脳の領域、細胞の種類、またはウイルスに応じて発現が異なる可能性があるため重宝されます。さらにウイルス発現を使用して脳への光照射でオプシンを発現し、脳の神経回路のマッピングなども可能です (Mei & Zhang 2012)。
対してウイルス発現と比較するとトランスジェニックマウスモデルは脳全体にオプシンを発現するように設計されています (Mei & Zhang 2012)。トランスジェニックモデルによっては、オプシンの発現は領域ごとに異なるため、ある特定の領域ではほかの領域よりもオプシンを多く発現する場合があります。トランスジェニックマウスモデルは特定の細胞タイプでオプトジェネティクス発現を安定して行うのに適した方法と言えます。また広い皮質領域を調べるためには単一の対象領域ではなく、より広範囲の発現を必要とするため、トランスジェニックマウスモデルを使用します。
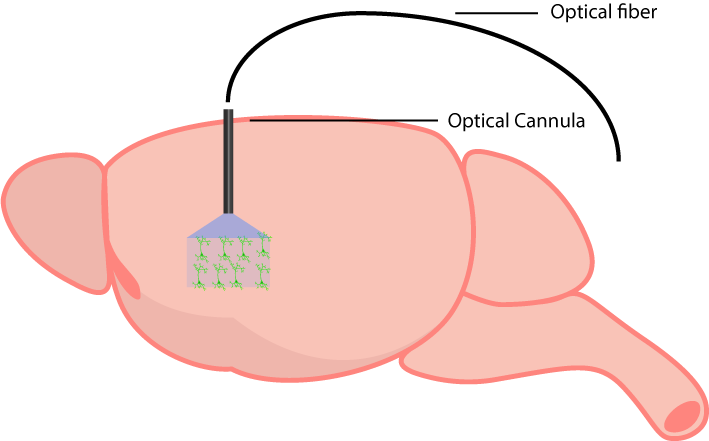
カニューレの埋め込み(自由行動用)
自由に行動するオプトジェネティクス実験では、動物が動いている間に脳に光を伝達する必要があります。これは、プローブを発現する脳領域に光カニューレを外科的に埋め込むことによって実現されます。光カニューレを選択する際には標的の脳領域に到達させるため適切な長さのものを選択することが重要です。
埋め込まれると光ファイバーケーブルを介して接続され、カニューレ下の領域に光が照射されます。光の広がりと浸透深度は組織と光源の波長に依存します(Deisseroth研究室の便利な計算サイト:https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)。
機器の選択
オプトジェネティクス実験には、顕微鏡と自由行動の 2 つの実験設定が使用されます。オプトジェネティクス刺激に対するこれら 2 つの異なるアプローチには、異なるコンポーネントがあります。
顕微鏡を使用したオプトジェネティクス
オプトジェネティクスは顕微鏡実験と並行して実行でき、様々な顕微鏡法と同期させることができます。
一般的にはオプトジェネティクス装置を電気生理学装置(通常は標準的な落射蛍光顕微鏡)に統合して、神経活動を記録します(Andrasi et al. 2017)。または、オプトジェネティクス装置を二光子顕微鏡に統合して、イメージング中に神経活動を調べる場合もあります (Forli et al. 2018)。
細胞生物学では、研究者はオプトジェネティクスシステムを共焦点イメージング実験に統合して、さまざまな遺伝子の乱れを調べます(van Haren et al. 2018)。
これらの顕微鏡セットアップとオプトジェネティクスシステムを統合するために必須の主要コンポーネントが 2 つ挙げられます。光源とフィルターのセットです。光源はサンプルを照らし、オプトジェネティクス プローブをアクティブ化するために使用され、オプトジェネティクス プローブに適した特性を持った光源を選択することが重要です。
ほとんどの顕微鏡セットアップでは、コリメートされた光源が背面の落射蛍光ポートに接続され、サンプルを照らします。光源に応じて、直接接続で顕微鏡の背面ポートに接続するか、ライトガイド/ファイバーで落射蛍光ポートに接続します。
光は落射蛍光ポートを通ってフィルターターレットを通過し、対物レンズを通してサンプルに照射されます。対物レンズによって、オプトジェネティクス刺激用の光源の視野とパワーが決まります (倍率が低いと視野は広くなりますが、光強度も低くなります)。
前述のように、光はサンプルに反射される前にフィルターターレットを透過します。したがって、適切なフィルター セットを選択して正しい波長をサンプルに向け、励起波長がカメラに侵入しないようにブロックすることが必要とされます。もう 1 つの方法は、顕微鏡とは独立してサンプルを外部から照らすことです。この特定のアプリケーションでは、ファイバー結合光源またはスポットライト光源を使用します。落射蛍光ポートがすでに他の用途で使用されている場合や、サンプルの一部をターゲットにしたい場合に使用されます。またこれらの光源を電気生理学またはイメージング機器と正確に同期させる必要があります。アナログまたは TTL 信号を介して光源を同期および制御できることは、適切な同期に不可欠です。研究者は電気生理学の記録中に特定の時間サイクルで光を照射を照射したい場合があります。

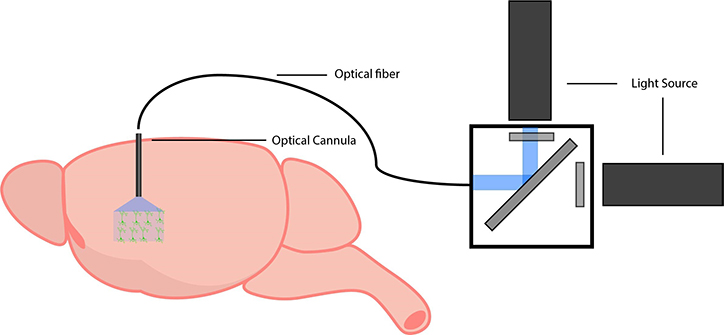
自由行動下でのオプトジェネティクス
オプトジェネティクスでは、神経回路と行動のつながりをテストすることが必要とされます。したがって研究者は自由に行動する動物でこの方法を実行する必要があり、顕微鏡を用いた実験とは異なるセットアップが必要とされます。
自由に行動する動物を用いた実験には、光カニューレ、光ファイバーケーブル、光源の 3 つの主要なコンポーネントが必要です。
前述のように、光カニューレはオプトジェネティクスプローブを発現する関心領域に埋め込まれ、脳に光を照射します。通常、光ファイバーは光カニューレに結合され、ファイバー結合光源に接続されます。これにより、光源から自由に行動する動物の脳に光が伝わります。柔軟な光ファイバーにより、動物の自由な行動を保ちつつ、オプトジェネティクス刺激のために脳へ光を照射することできます。
動物の行動の複雑さに応じて、研究者はコミュテータを使用することがあります。これにより、ファイバーがねじれて動物の行動が制限されるのを防ぎます。
研究者は、顕微鏡によるオプトジェネティクス実験と同様に、オプトジェネティクス刺激を特定の行動イベントまたは機器と同期させたい場合があります。たとえば、動物が特定の領域に移動した場合、研究者は特定のオプトジェネティクス刺激を実行したい場合があります。これは、TTL またはアナログ信号との同期によって可能になります。
Chapter3:ライトソースの選択 LED vs. Laser
オプトジェネティック光源を選択する際には、必要な光波長と強度という 2 つの重要な要素を考慮する必要があります。
まず、選択したオプシンには特定の活性化スペクトルがあり、オプシンは特定の光波長によってのみ活性化されます。オプシンには通常、最小の光出力で応答を引き出すことが可能なピーク波長が存在します。仮に最適なピーク波長から離れた波長で刺激した場合は、オプトジェネティック応答を引き出すのにさらに強力な光出力が必要となります。したがって、最適な活性化を実現するには、ピーク波長に近い光源を選択するのが最善です。例えば、ほとんどの研究者は、ChR2 のオプトジェネティック活性化に 470nm に近い波長を使用します。
次に、実験に必要な光強度は、視野と選択したオプシンによって異なります。視野は光ファイバー (in vivo 実験の場合) または顕微鏡の対物レンズによって異なり、光源でカバーする必要がある領域の大きさが決まります。オプシンには、照明によって応答を引き出すための強度しきい値があります。これら 2 つの変数は直接的に結びついており、反応を引き出すには最適な照明パワーが必要であり、視野を広げるには、より広い領域で必要な閾値をカバーする必要があるため、より多くのパワーが必要になります。
オプトジェネティクス光源の要件を理解したところで、このアプリケーションで最も一般的に使用される 2 つの光源、LED 光源とレーザー光源について解説いたします。
LED光源
LED は、さまざまな理由からオプトジェネティクス実験に最適な光源です。まず、LED は低コストで安全性が高く、寿命も長いため、オプトジェネティクス実験を検討している研究室にとって最適な選択肢となりえます。
重要な点として、LED は幅広い波長 (UV から NIR まで) から選択可能なため、オプシンの選択に適切な LED を容易に見つけることが可能です。波長に応じて、LED 間で利用可能な出力は大幅に異なります。可視域では、高出力LEDが存在するため、オプトジェネティクス実験に最適な光源と言えます。
ハロゲン ランプやキセノン ランプなどの他の一般的な顕微鏡光源と比較して、LED は動作温度が低く、ウォームアップや冷却時間を必要としません。これにより、実験中に簡単に LED をオン/オフにすることができ、 使用者はLED の安定性や損傷を心配することなく、出力やパルスを簡単に調整できます。さらに、従来の光源よりも寿命がはるかに長く、頻繁に交換する必要がないため、長期的にみるとコストパフォーマンスに優れています。
また、LED はマイクロ秒単位でオン/オフを切り替えることができることも大きな利点となります。TTL 経由で外部装置と同期しすることも可能です
レーザー光源と比較すると、LED は比較的出射角度が広く、パワーが視野全体に広がります。、拡散性についてはLED は水銀ランプやハロゲン ランプなどの従来の光源よりもはるかに優れています。ただし視野全体を点やラインごとにスキャンするために光を小さなスポットにしっかりと集束させる必要があるシステムなどのアプリケーションについてはレーザーの方が適しています。
第 2 に、LED はレーザーと比較してスペクトル帯域幅も広くなっています。光学フィルターを使用して LEDスペクトルの裾野を簡単にカットできるため、実験に悪影響を与える場合とそうでない場合がありますが、出力は LED 光源の全スペクトルに基づいているため、光学フィルターを使用すると LED からの出力全体が低下する可能性があります。
LED は、さまざまなオプトジェネティクス実験に適しています。LED の一般的な用途は、顕微鏡での広視野オプトジェネティクスです。LED は、正立顕微鏡や倒立顕微鏡に簡単に統合でき、すべてのオプトジェネティクス プローブを刺激するのに十分な出力を提供します。さらに、LED は電気生理学機器と簡単に同期できます。
LEDは、光ファイバーと結合し十分な出力を提供できるため、自由に動作するオプトジェネティクス実験にも最適です。
レーザー光源
レーザーは、より高い強度やより狭い焦点の光を必要とするオプトジェネティクス実験によく使用されます。単一のスポットで非常に高い強度を提供するため、レーザースキャンアプリケーションによく使用されます。
LEDと比較すると、レーザーのスペクトル幅は非常に狭いため、ユーザーは特定の波長で高い強度を得ることができます。顕微鏡に収まるように十分にコリメートすることも、高い光出力を必要とするオプトジェネティクス実験用に光ファイバーに効率的に結合することも可能です。
上述の通り、高い強度を提供しますが、高い出力は特定のオプトジェネティクス実験の落とし穴となる可能性があります。特に、顕微鏡実験では、レーザーの出力が高すぎて組織損傷を引き起こす可能性があります。またスポットが小さいため広視野を照らす場合は光を拡散させ、レーザースペックルを補正する必要があります。
LED とは異なり、レーザーは使用できる波長が限られています。また、LED よりもはるかに高価で、インターロックなどの目の安全対策が必要になる場合があります。
光結合効率が高いため、マクロスコープなどの広い領域でオプトジェネティクスを実行する場合に特に便利です。レーザーは、高強度が必要とされる可能性のある生体内でのオプトジェネティクス アプリケーションにも使用できますが、ほとんどの LED は生体内オプトジェネティクス アプリケーションに適しています。
レーザーが LED より優れているのは、レーザー スキャンと 2 光子顕微鏡オプトジェネティクス実験です。これは、レーザーの方が長波長で小さなスポットに高強度を提供できるためです。
Chapter4:広視野 vs 細胞分解能オプトジェネティクス
オプトジェネティクスは、遺伝的に定義された神経活動を光で操作する技術で、2 つの主な利点があります。
- ミリ秒単位の時間精度
- 遺伝的に定義された空間精度
時間精度により、研究者はミリ秒単位のタイミングでニューロンのオン/オフを切り替えることができます。この高速タイミングにより、脳内のニューロンの発火を精密に模倣できます。
空間精度により、研究者は遺伝的に定義されたニューロン集団(抑制性ニューロンなど) の活動を操作できます。これにより、遺伝的に定義された集団の操作と測定対象の変数の間に因果関係が生まれます。
オプトジェネティクス実験では、オプトジェネティクス プローブを発現するニューロンのみが制御され、それらのニューロンが活性化または抑制されます。
ただし、標準的なオプトジェネティクス光源は視野全体を照らすだけなので、結果としてオプトジェネティクス プローブを発現するすべてのニューロンを刺激します。このようなシステムは、オプトジェネティクス発現ニューロンをすべて同時に刺激する必要がある実験には適していますが、より高度な実験では、視野内の個々のニューロンを選択的に刺激する必要がある場合があります。
ニューロン集団内の特定のニューロンを照射する機能は、細胞分解能オプトジェネティクスと呼ばれます(Shemesh et al. 2017)。この方法では、個々のニューロンを選択的に刺激するために、より洗練された空間精度が必要です。
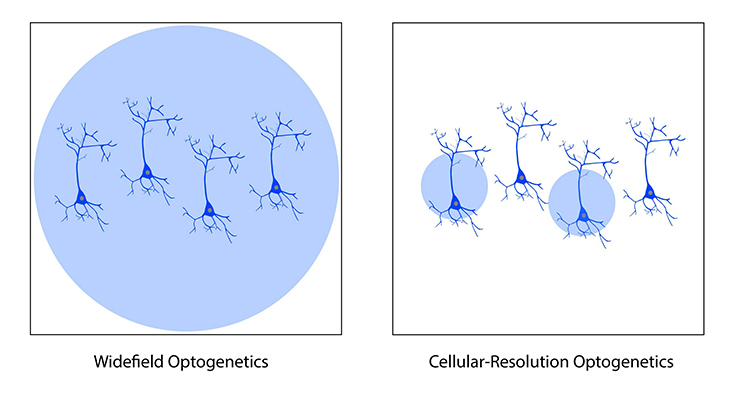
オプトジェネティクスで使用される標準的な光源では、視野内のすべての細胞を照らすことしかできず、個々のニューロンをターゲットにすることができませんでした。
近年、空間的にターゲットを絞った光技術の開発により、個別の細胞に光を絞って照射する細胞解像度のオプトジェネティクスが可能になりました (Ronzitti et al. 2017)。例えば、Mightex の Polygon デジタル マイクロミラー デバイス (DMD) を使用すると、複数の個々のニューロン、または領域を同時に照らすことができ、細胞解像度のオプトジェネティクスを実行できます。
細胞解像度のオプトジェネティクスは、神経科学の分野で複数の用途があります。例えば、神経回路を研究し、個々のニューロンのレベルで神経パターンを解読できます (Anastasiades et al. 2020; Tran et al. 2019)。こうした研究は、様々な技術を使用して、in vitro と in vivo の両方で行われてきました(Shemesh et al. 2017; Anastasiades et al. 2020; Tran et al. 2019; Chen et al. 2019)。細胞解像度の光遺伝学の実験的応用は無限と言えるでしょう。
Chapter5:細胞分解能のオプトジェネティクスシステム
ニューロンの集団内の特定のニューロンを照射することは、cellular-resolution optogenetics(細胞分解能 光遺伝学)と呼ばれます (Shemesh et al. 2017)。この技術を使用するには、光遺伝学的発現集団内の個々のニューロンを選択的に刺激するためのより高度な空間特異性を必要とします。
空間的にターゲットを絞った光技術の開発により、個々の細胞などのサンプルを光が照射する場所を制御できるようになり、細胞分解能光遺伝学が可能になりました(Ronzitti et al. 2017)。
以下で細胞分解能光遺伝学のためのシステムを比較します。
ガルバノスキャン
ガルバノスキャンは、ガルバノミラーのペアを使用して、サンプルの特定の領域に焦点を合わせた光線を向けるシリアルスキャン方式を使用します。
この「ガルバノベースのスキャン」技術では、通常、光刺激に高出力レーザービーム(調整可能または固定波長)を使用します。照明は一度に 1 つのスポットに制限され、スポットの強度はガウス分布に従います。複数の領域への照射は、異なるポイントを順番に照射することで実現されます。
このシステムの時間精度は主にガルバノミラーの位置決めアクチュエータによって制限されます。従来のガルバノベースのスキャンシステムでは、ビームを新しい ROI (関心領域)にリダイレクトするのに約 100 μs かかります。その結果、視野全体をスキャンしてパターンを生成するには、かなりの時間がかかります。このシステムにおける時間精度の制限は、数100Hz のオーダーで発火する活動電位の生成など、高速な生理学的イベントを刺激して記録する際に障壁となります。
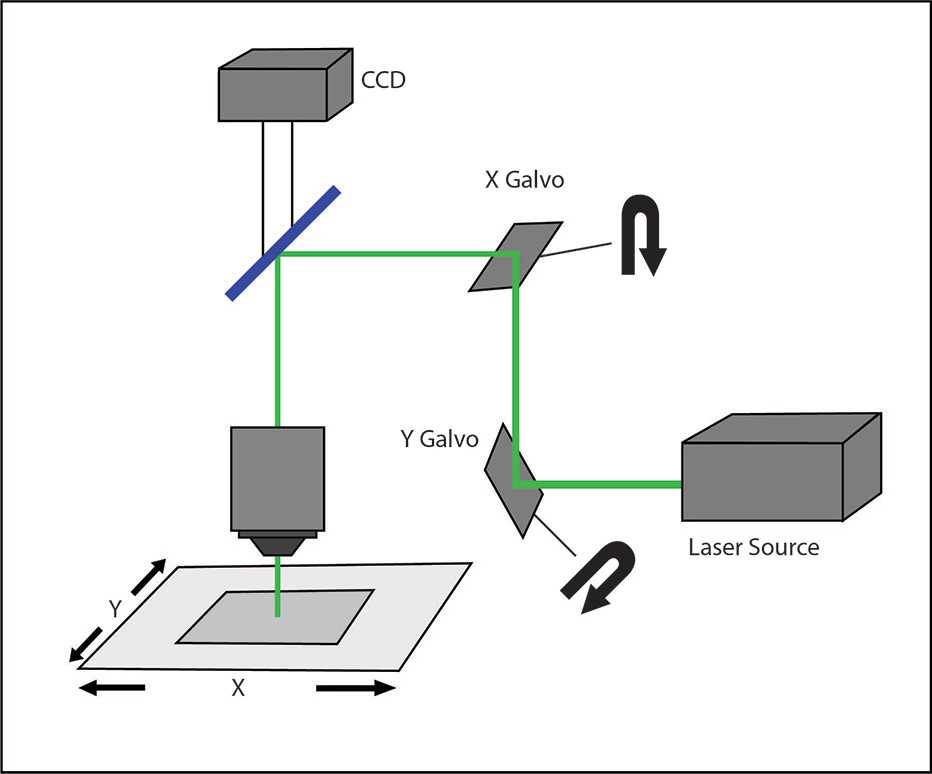
ガルバノベースのスキャン システムは、複数の関心領域を同時に照射できないため、システムの用途が根本的に制限されます。複数のニューロンが同時にどのように動作するかという疑問に対処できないためです。
ガルバノスキャンの利点は、光路に沿った光強度の損失が最小限であることです。したがって、集束ビームはサンプルに優れた照射強度を提供し、同じシステムを光照射とイメージングの両方に使用できます。さらに、照射はかなり均一で、他の光源からの背景干渉の影響を受けません。
ガルバノベースのスキャン システムを使用した細胞解像度の光遺伝学は、一般的にユーザーフレンドリーで、既存のシステムとの統合が容易で、in vitro および in vivo の頭部固定実験の両方に使用できます。ガルバノミラー自体は高額ではありませんが、コストがかかる高出力レーザーとガルバノを制御するソフトウェアが必要になるため、システム全体でコストが膨らむ可能性があります。
ホログラフィックプロジェクション
位相と振幅の並列励起、空間光変調技術は、細胞分解能のオプトジェネティクスに使用可能です。並列励起法は、サンプル上の複数の回折限界スポットを同時に照射できるため、さまざまな実験ニーズに適応できます。位相変調では、通常、コンピューター生成ホログラム (CGH) を利用して、一度に複数のポイントを刺激します。必要な照射パターンはコンピューターで設計され、その後、適切な位相ホログラムを計算する数値アルゴリズムによってパターン化された照射の投影が生成されます。次に、このホログラムは空間光変調器 (SLM) に投影されます。参照ビームは SLM に反射され、一連の結像光学系を通過して、再構成された照射パターンをサンプルに照射します。ホログラフィック システムには、任意の数と形状の 3 次元パターンを同時にサンプルに刺激できるという利点があります。ただしホログラフィック システムでは、新しいパターンを計算して生成するのに最大数分かかるため、迅速なパターン生成やリアルタイムのパターン生成を必要とするアプリケーションには、この方式は最適ではありません。
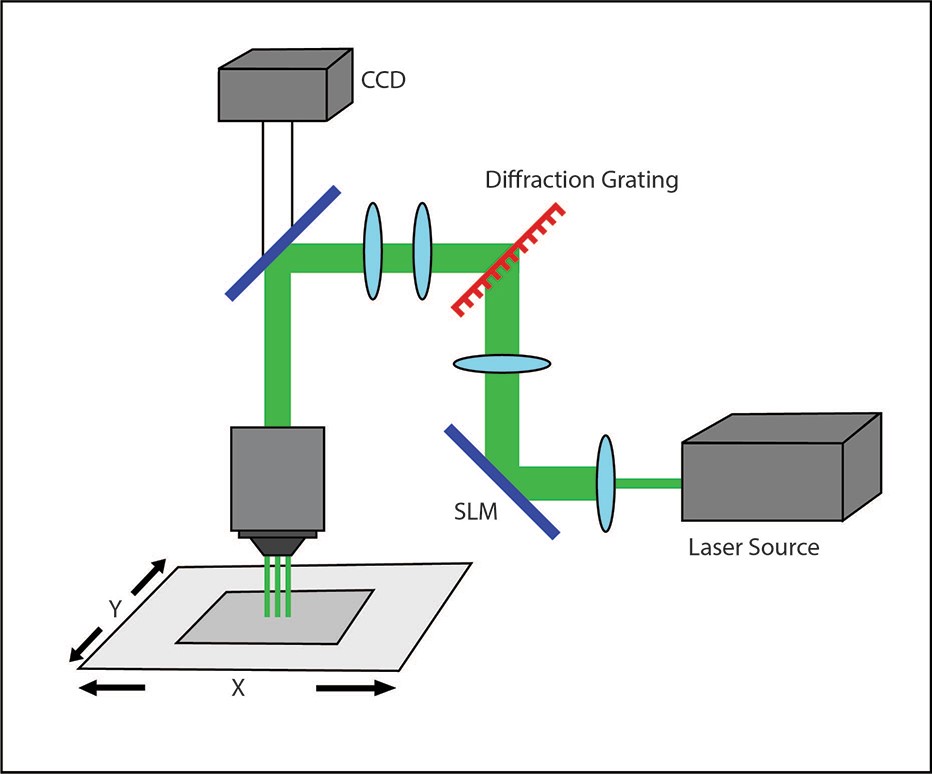
このシステムは理論的には良好な照明強度を実現しますが、実際には効率に関する懸念があります。照明スポットは不均一で、端に向かって強度が連続的に減少するのが難点です (Lutz 他 2009)。このため、照明ポイントと背景のコントラストが悪く、照明のエッジがはっきりしません。
ホログラフィック システムは最も高価で、かつ既存のシステムとの統合が最も困難です。適切に使用するにはかなりの専門知識が必要であり、主に部品 (レーザーと SLM、およびコンピューターのハードウェアとソフトウェア) の高コストにより、非常に高価になる可能性があります。また、特に意図しないスペックル パターンの場合、システムのパターン照明の精度と再現性が信頼できないという懸念もあります。したがって、実験用に機能するシステムを作成するためにかなりのレベルの専門知識が必要です。
DMDイルミネーター
オプトジェネティクス実験で一般的に使用される 3 番目のシステムは、Mightex の Polygon DMD Illuminator などのデジタル マイクロミラー デバイス (DMD) を採用しています。DMD は、それぞれが独立して制御できる多数の微小ミラーのアレイです。
照明されると、各マイクロミラーはユーザーが定義した照明パターンのピクセルに対応し、個別に独立して制御してサンプルに光を反射できます。ミラーは、オンまたはオフの状態に約 12 度回転します(Knapcsyk & Krishnan 2005)。
ホログラフィック パターン投影と同様に、DMD システムは複数の個別の ROI を同時に刺激できるため、背景に対して高いコントラストを維持しながら複数の細胞を並行して励起できます。マイクロミラー アレイはサンプルに光の単一ピクセルを反射するように機能するため、サンプル上の照明スポット サイズは、対物レンズと DMD チップ上のマイクロミラーの数によってのみ制限されます。
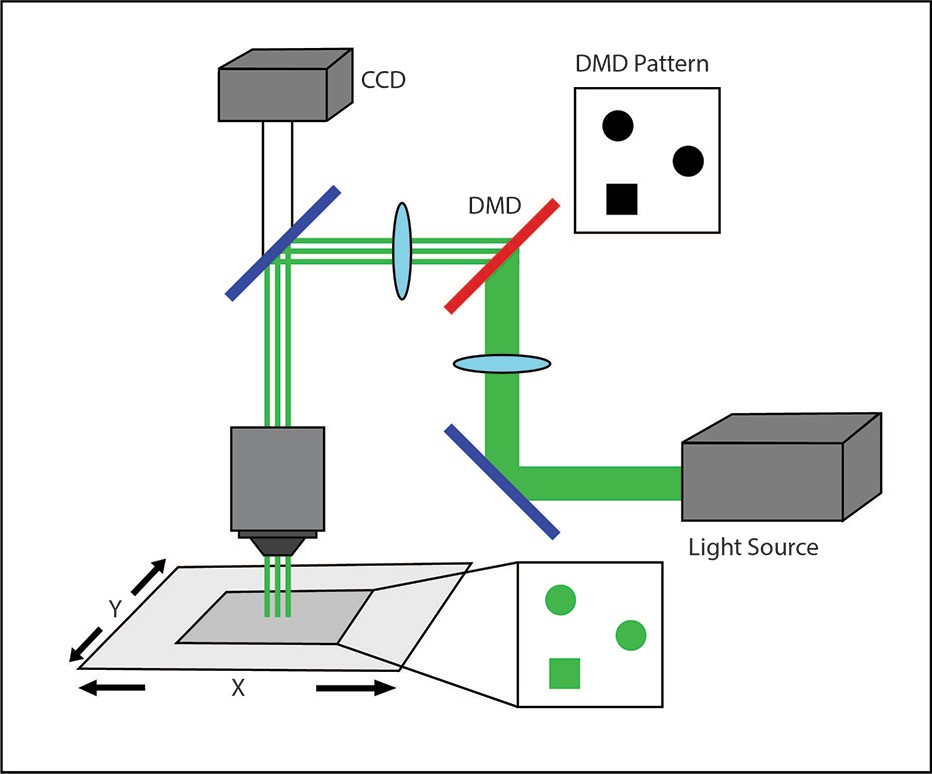
高コントラストのピクセルの利点は、照明が意図したパターン領域内にうまく収まることです。鋭い照明エッジにより、光が関心領域にのみ向けられ、光を照射したくない不要な領域に漏れることがなくなります。これにより、励起実験をより細かく制御できます。
加えて本システムの重要な利点は、時間精度です(Wilt et al. 2009)。リアルタイムのパターン生成も実現でき、これは、移動するターゲットを追跡し、正確な照明パターンを生成してターゲットに届ける必要があるクローズドループ実験で特に役立ちます。
またガルバノスキャナやホログラフィックプロジェクターとは異なり、DMD 照明装置は、サンプルを照らすためにほぼすべての光源 (レーザー、LED、キセノン、メタルハライドなど) で使用できます。
DMD ベースのシステムは、サンプル全体にわたって照明の均一性が非常に高いため、特定の照明エリア全体で均一性が維持されるだけでなく、視野内の位置に関係なく、個別の照明エリア全体で強度が一定になります。さらに、照明の干渉を引き起こすバックグラウンド ノイズ (コントラスト比 1000:1) は非常に少なく、ガルバノスキャンシステムのように不要な照明パターンは生成されません。
したがってDMD システムは、特定のパターンでの細胞タイプの活性化の影響を研究するのに最も役立ちます (Blumhagen et al. 2011; Munch et al. 2009)。DMD は、in vitro オプトジェネティクスのほか、C. elegans (Leifer et al. 2011)、ゼブラフィッシュ (Zhu et al. 2012)、マウスなどの生物を使用した in vivo オプトジェネティクス実験にも広く使用されており、行動中の動物に光学的にアクセスできます。
本記事で解説した 3 つのシステムのうち、DMD システムは最も低コストで最も使いやすいシステムです。既存の顕微鏡と簡単に統合でき、適応性も非常に優れています。
システム比較
| ガルバノスキャン | ホログラフィック | DMDイルミネーター | |
|---|---|---|---|
| 光源 | レーザーのみ | レーザーのみ | レーザーもしくはLED |
| 複数領域への光刺激 | × | 〇 | 〇 |
| 使用する難易度 | 〇 | △ | ◎ |
| 二光子顕微鏡への応用 | 〇 | 〇 | 〇 |
| コスト | 中 | 高 | 低 |
| 主なデメリット | 点での刺激 | 高いコスト、正確に制御することが難しい | マイクロミラーによる光損失がある |